
~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
ENGLISH

08-08-2025-Materials Technologies - Atomic Structure [EN]-[IT]
With this post, I would like to provide a brief overview of the topic mentioned above.
(code notes: X-98)
Atomic Structure

Image created with artificial intelligence, ChatGPT software used
Introduction
Today, in the field of materials technology, we have key innovations such as smart and sustainable materials, materials that perform structural and energy storage functions (Structural Battery Composites), materials that change temperature only through mechanical stress, etc...etc...
As we know, to understand the behavior of a material, it's important to study the matter it's composed of. All the matter around us, from metals to polymers, from rocks to air, is composed of atoms.
How an atom is made
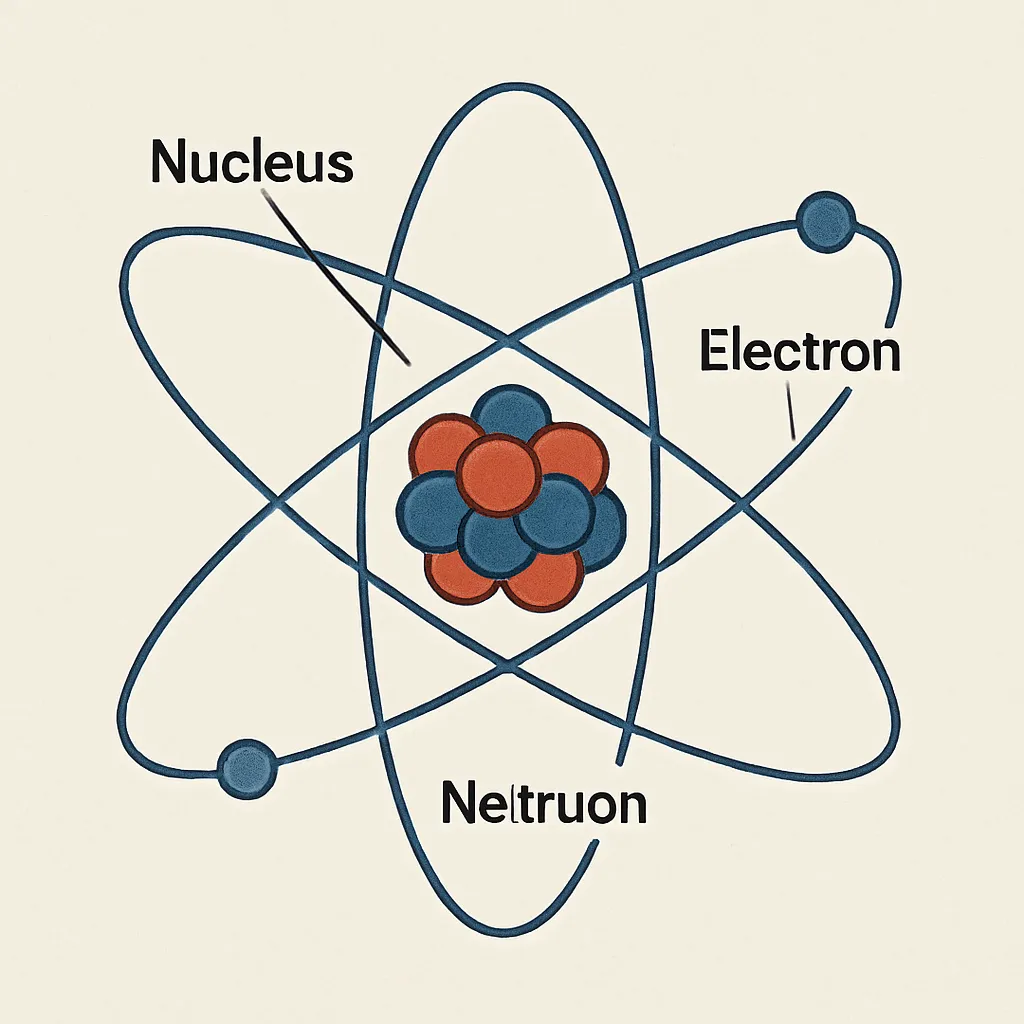
Image created with artificial intelligence, the software used is Microsoft Copilot
First, let's write the basic concept below.
Atoms are the basic unit of matter.
Therefore, to understand the various classes of materials, it's necessary to know the fundamental aspects of atomic structure and the bonds that can occur between atoms.
The atom is made up of three subatomic particles: protons, neutrons, and electrons.
Essentially, the atom has a nucleus containing neutrons and protons, and this is surrounded by a finely dispersed cloud of electrons of varying density.
We can say that the nucleus of an atom is approximately 10^-15 m in size, while the dimensions of an entire atom can be 10^-10 m.
When measuring these dimensions, we talk about a femtometer, a strange word that even I have heard very few times in my life.
1 femtometer (fm) = 10⁻¹⁵ meters
For example, the radius of the nucleus of a hydrogen atom is 1.7 fm
Yes, you are! Are you surprised? There's more beyond the nanometer! Below is a table of decreasing prefixes, multiples less than 1 meter.

The table above was created using artificial intelligence; the software used was ChatGPT
The proton, neutron, and electron have different masses and different charges.
Below is a table with data about the proton, neutron, and electron.
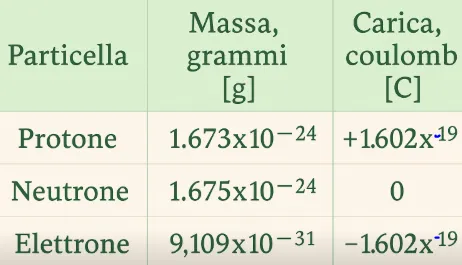
From the data in the table, we can see that the electron has a significantly lower mass than a proton and a neutron. Another interesting thing the table suggests is that the proton and the electron have practically the same charge, but opposite signs, while the neutron has a charge of zero.
The Orbital
A very important concept in atomic structure is that of the orbital.
Each electron in each atom has a region of maximum electron density, that is, a region where the probability of finding that electron is greatest (about 90%). This region is called an orbital, and each orbital corresponds to a specific energy value (quantized energy).
We can say that the electron cloud makes up most of the atom's volume, but represents a very small portion of its mass.
We can therefore say that an atomic orbital represents the region of space that contains the maximum probability of finding a given electron.
Below is an image of an atom with the orbitals represented.
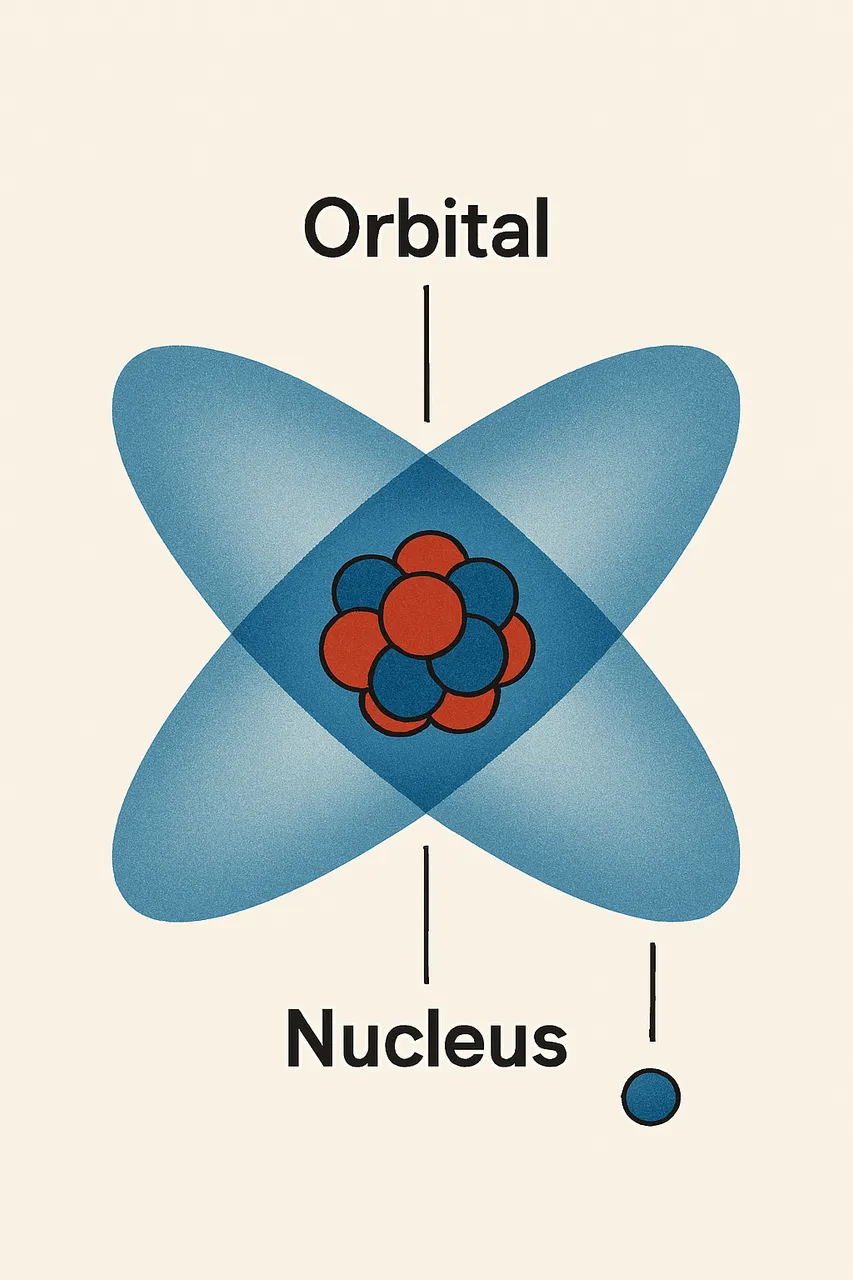
Image created with artificial intelligence, the software used is Microsoft Copilot
The blue ellipses in the image represent orbitals, i.e., the regions of space where an electron is most likely to be found.
An important concept regarding orbitals is that an orbital exists only if there is an electron occupying it.
WARNING: An orbital is not a trajectory, but a wave function that describes the spatial distribution of the electron.
Pauli Exclusion Principle
Each orbital can contain a maximum of two electrons, which must have opposite spins.
Simply put, we can compare an orbital to a room with a specific shape and size, while the electron is the occupant.
Important
When an electron changes orbital, the atom can emit or absorb photons.
The Outer Electrons
Another very important part of the structure of the atom are the outer electrons, because electrons, especially the outer ones, determine most of the electrical, mechanical, chemical, and thermal properties of atoms.
The Heisenberg Uncertainty Principle
After talking about electrons and orbitals, we think we understand that we can know where an electron is, since it should be in its orbital. This isn't quite the case. It's not easy to know exactly where an electron is.
In this regard, Heisenberg helps us find an electron with his principle.
Heisenberg's uncertainty principle is a fundamental concept of quantum mechanics. This principle states that it is not possible to know with absolute precision and simultaneously both the position and the momentum (i.e., velocity × mass) of a subatomic particle.
In other words, Heisenberg says that it is not possible to know the position and momentum of a particle like the electron simultaneously.
Quantum Numbers
Here is the scheme for filling orbitals according to the Aufbau principle.

Image created with artificial intelligence, ChatGPT software used
Quantum numbers are parameters that describe the energy and spatial state of an electron within an atom.
Each electron has quantum numbers that define its energy content and, therefore, the orbital it occupies.
n
The first quantum number, called the principal number and denoted by the letter n, establishes the energy content of the orbital, i.e., its energy level.
l
The second quantum number, called the azimuthal number and denoted by the letter l, determines the shape of the orbital.
The first two quantum numbers (n and l), together, define the overall energy content of each orbital.
m
The third quantum number, called the magnetic number and denoted by the letter m, defines the orientation of the orbital in space.
ms
The fourth quantum number, called the spin number and denoted by the letter ms, gives the electron intrinsic angular momentum.
Regarding the behavior of electrons, we can say that they first fill the lowest energy levels and then move to higher ones.
To clarify quantum numbers, we can say that quantum numbers define the orbital in which an electron can be found, and each orbital is identified by a unique set of quantum numbers.
Conclusions
Since electrons, especially the outer ones, determine most of the electrical, mechanical, chemical, and thermal properties of atoms, even a basic understanding of atomic structure is necessary. This is of considerable importance for the study of materials.
Question
Did you know that the famous German scientist Heisenberg, one of the fathers of quantum mechanics, was arrested by the Americans in May 1945 while riding his bicycle in Bavaria, apparently unaware of the fall of the Nazi regime? My research, however, shows that he was treated with respect.

ITALIAN

08-08-2025-Tecnologie dei materiali - Struttura atomica [EN]-[IT]
Con questo post vorrei dare una breve istruzione a riguardo dell’argomento citato in oggetto
(code notes: X-98)
Struttura atomica

immagine creata con l’intelligenza artificiale, il software usato è ChatGPT
Introduzione
Oggi nel settore della tecnologia dei materiali abbiamo innovazioni chiave come i materiali intelligenti e sostenibili, materiali che svolgono funzione strutturale e di accumulo energetico (Structural Battery Composites), materiali che mutano temperatura solo mediante sollecitazione meccanica, ecc...ecc...
Come sappiamo per comprendere il comportamento di un materiale è importante lo studio della materia da cui è composto. Tutta la materia che ci circonda, dai metalli ai polimeri, dalle rocce all'aria, è composta da atomi.
Come è fatto un atomo

immagine creata con l’intelligenza artificiale, il software usato è Microsoft Copilot
Innanzitutto scriviamo il concetto base qui di seguito.
Gli atomi sono l’unità base della materia.
Per comprendere quindi le varie classi dei materiali è necessario conoscere gli aspetti fondamentali della struttura atomica e dei legami che possono avvenire tra gli atomi.
L'atomo è costituito da 3 particelle subatomiche: i protoni, i neutroni e gli elettroni.
Sostanzialmente l'atomo ha un nucleo in cui ci sono neutroni e protoni, e questo è circondato da una nuvola di elettroni finemente dispersa di densità variabile.
Possiamo dire che approssimativamente il nucleo di un atomo è grande 10^-15 m, mentre le dimensioni di un atomo intero possono essere di 10^-10 m.
Quando si misurano queste dimensioni parliamo di femtometro, una parola strana che anch'io nella mia vita ho sentito veramente poche volte.
1 femtometro (fm) = 10⁻¹⁵ metri
Ad esempio il raggio del nucleo di un atomo di idrogeno è 1,7 fm
Ebbene si!!! siete sorpresi? oltre il nanometro c'è dell'altro!! Qui di seguito una tabella di prefissi decrescenti, multipli minori di 1 metro.

tabella qui sopra creata con l’intelligenza artificiale, il software usato è ChatGPT
Il protone, il neutrone e l'elettrone hanno massa diverse e cariche diverse
Qui di seguito una tabella con in dati riguardo al protone, neutrone ed elettrone.

Dai dati della tabella possiamo notare come l'elettrone abbia una massa decisamente inferiore ad un protone ed un neutrone. L'altra cosa interessante che ci suggerisce la tabella è che il protone e l'elettrone hanno praticamente quasi la stessa carica, ma di segno opposto, mentre il neutrone ha una carica pari a 0.
L'orbitale
Un concetto della struttura atomica molto importante è quello dell'orbitale.
Ciascun elettrone in ciascun atomo presenta una zona di massima densità elettronica, cioè una zona in cui è massima la probabilità di trovare l’elettrone stesso (circa il 90%). Tale zona è denominata orbitale e a ciascun orbitale corrisponde un ben determinato valore di energia (energia quantizzata).
Possiamo dire che la nuvola elettronica costituisce la maggior parte del volume dell'atomo, ma rappresenta una piccolissima parte della sua massa.
Possiamo dire che un orbitale atomico rappresenta quindi la regione dello spazio che racchiude la massima probabilità di trovare un determinato elettrone
Qui di seguito un immagine di un atomo con la rappresentazione degli orbitali

immagine creata con l’intelligenza artificiale, il software usato è Microsoft Copilot
Le ellissi azzurre nell'immagine rappresentano gli orbitali, cioè le regioni dello spazio dove è più probabile trovare un elettrone.
Un concetto importante che riguarda gli orbitali è che un orbitale esiste solo se c’è un elettrone che lo occupa.
ATTENZIONE: Un orbitale non è una traiettoria, ma una funzione d’onda che descrive la distribuzione spaziale dell’elettrone.
Principio di esclusione di Pauli
Ogni orbitale può contenere massimo due elettroni, che devono avere spin opposto
In parole semplici possiamo dire che l’orbitale possiamo paragonarlo ad una stanza con una forma e dimensione precise, mentre l’elettrone è l’inquilino.
Importante
Quando un elettrone cambia orbitale, l’atomo può emettere o assorbire fotoni.
Gli elettroni esterni
Un altra cosa importantissima che fa parte della struttura dell'atomo sono gli elettroni esterni, perché gli elettroni, in particolare quelli esterni, determinano la maggior parte delle proprietà elettriche, meccaniche, chimiche e termiche degli atomi.
Il principio di indeterminazione di Heisenberg
Dopo aver parlato di elettroni e degli orbitali, pensiamo di aver capito che possiamo spere dove è un elettrone, visto che dovrebbe essere nell'orbitale. Non è proprio così. Non è facile sapere esattamente dov'è un elettrone.
A tal proposito ci aiuta Heisenberg a trovare un elettrone con il suo principio.
Il principio di indeterminazione di Heisenberg è un concetto fondamentale della meccanica quantistica. Questo principio afferma che non è possibile conoscere con precisione assoluta e simultaneamente sia la posizione che la quantità di moto (cioè velocità × massa) di una particella subatomica.
In altre parole Heisenberg dice che non è possibile conoscere simultaneamente posizione e quantità di moto di una particella come l'elettrone.
I numeri quantici
Qui si seguito lo schema del riempimento degli orbitali secondo il principio di Aufbau.

immagine creata con l’intelligenza artificiale, il software usato è ChatGPT
I numeri quantici sono dei parametri che descrivono lo stato energetico e spaziale di un elettrone all’interno di un atomo.
Ad ogni elettrone spettano dei numeri quantici che definiscono il suo contenuto di energia e, quindi, l’orbitale occupato.
n
Il primo numero quantico, detto principale e indicato con la lettera n, stabilisce il contenuto energetico dell’orbitale, cioè il livello di energia.
l
Il secondo numero quantico, detto azimutale e indicato con la lettera l, stabilisce la forma dell’orbitale.
I primi due numeri quantici (n e l), insieme, definiscono il contenuto complessivo di energia che spetta a ciascun orbitale.
m
Il terzo numero quantico, detto magnetico e indicato con la lettera m, definisce l’orientamento dell’orbitale nello spazio.
ms
Il quarto numero quantico, detto di spin e indicato con la lettera ms, attribuisce all’elettrone un momento angolare intrinseco
Per quanto riguarda il comportamento degli elettroni possiamo dire che essi riempiono prima i livelli a energia più bassa e poi passano a quelli più alti.
Per fare chiarezza sui numeri quantici possiamo dire che i numeri quantici definiscono l’orbitale in cui può trovarsi un elettrone e ogni orbitale è identificato da un set univoco di numeri quantici.
Conclusioni
Siccome gli elettroni, in particolare quelli esterni, determinano la maggior parte delle proprietà elettriche, meccaniche, chimiche e termiche degli atomi è necessaria una conoscenza, anche solo di base, della struttura atomica. Questo è di notevole importanza per lo studio dei materiali.
Domanda
Lo sapevate che il famoso scienziato tedesco Heisenberg, uno dei padri della meccanica quantistica, fu arrestato dagli americani nel maggio 1945 mentre si trovava in Baviera, in sella a una bicicletta, apparentemente ignaro della caduta del regime nazista? Dalle mie ricerche risulta comunque che fu trattato con rispetto.
THE END