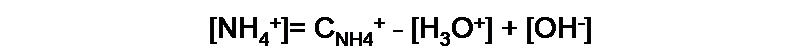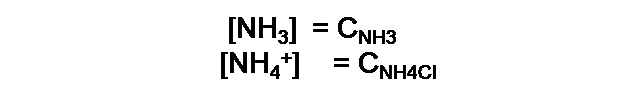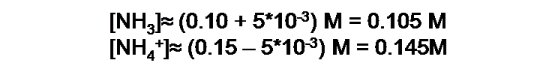¡Hola estimados amigos!
 Fuente: @yusvelasquez
Fuente: @yusvelasquez- Componentes del buffer básico
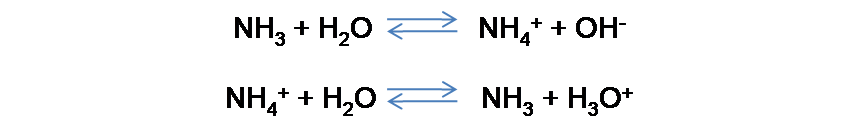
En el caso de un buffer básico, los componentes son una base débil y su ácido conjugado. Por ejemplo, se tiene la solución formada por el NH3 y el NH4Cl. Los equilibrios involucrados son los siguientes:
- Ecuaciones para el cálculo de pH
A partir de los equilibrios mostrados, se puede realizar un balance de masa, relacionando inicialmente la concentración de la base con su concentración analítica (CNH3), tendremos entonces la siguiente expresión:
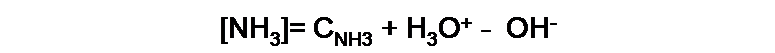
Observaremos que la [NH3] se reduce en la misma cantidad que [OH-] aumenta, mientras que en la segunda reacción de equilibrio, se observa que la [NH3] aumenta en la misma cantidad que [H3O+].
Si analizamos ahora [NH4+], observaremos que en la primera reacción de equilibrio aumenta en la misma cantidad que [OH-], y en el segundo equilibrio disminuye en la misma cantidad que [H3O+]. La expresión del balance de masa en este caso es:
Ambas expresiones se pueden simplificar ya que generalmente la diferencia entre estas concentraciones de estas dos especies es muy pequeña si se compara con la concentración de la base y el ácido conjugado. Para obtener:
Al sustituir las expresiones [NH3] y [NH4+] en la expresión de la constante de disociación de la base (Kb) y aplicando logaritmo se obtiene la ecuación de Henderson-Hasselbalch:
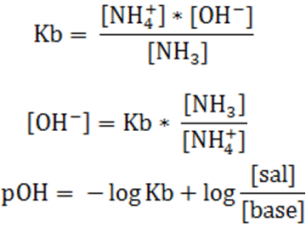
- Cálculo del pH
Apliquemos la ecuación en el cálculo del cambio de pH (∆pH) que se produce en 200mL de la solución buffer formada por NH3 0.10M y NH4Cl 0.15 cuando se adicionan 50 mL de NaOH 0.05M.
Primer paso: calcularemos el pH de la solución buffer:
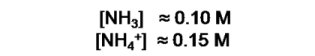
Empleando la ecuación de Henderson se tiene:
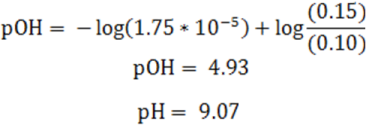
Segundo paso: Calculemos el pH de la solución buffer al adicionar 50mL de NaOH 0.025M
Comencemos por calcular la [NaOH]
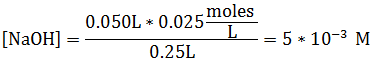
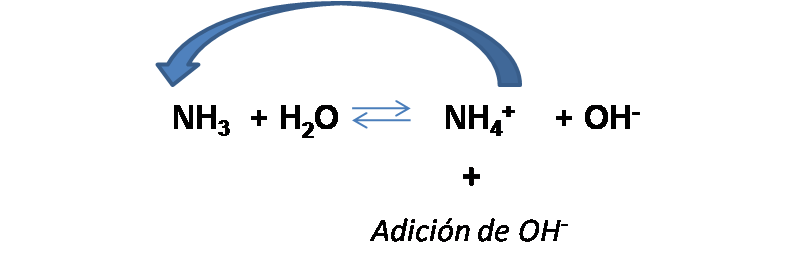
Al observar la reacción, podemos deducir que al adicionar cierta cantidad de base, el equilibrio se desplaza hacia la izquierda, reduciendo la [NH4+] y aumentando la [NH3]. Entonces, se tienen las nuevas concentraciones:
Al sustituir en la ecuación de Henderson se tiene
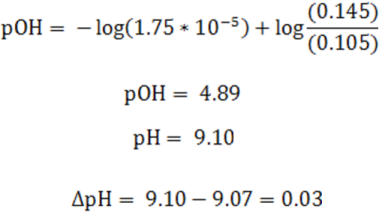
Como se puede observar la variación del pH es muy pequeño, resistiendo así la solución la adición de la base fuerte.
El pH de la solución buffer puede verse afectada cuando se adiciona ácido fuerte. Calculemos ahora la variación de pH al adicionar 50mL de HCl 0.025M.
Paso 1: calcular el pH de la solución buffer:
Este paso ya re realizó en la parte anterior, y como resultado tenemos un buffer con un pH igual a 9.07
Calculemos ahora la [HCl]
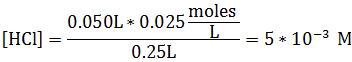
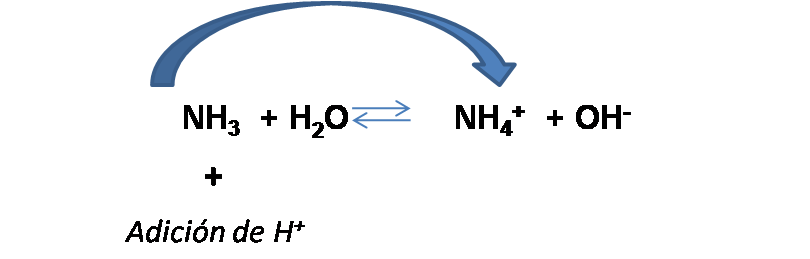
Si observamos la reacción, podemos deducir que al adicionar cierta cantidad de ácido el equilibrio se desplaza hacia la derecha, reduciendo la [NH3] y aumentando la [NH4+]. Por tanto, las nuevas concentraciones son:
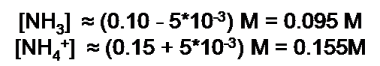
Al sustituir en la ecuación de Henderson se tiene
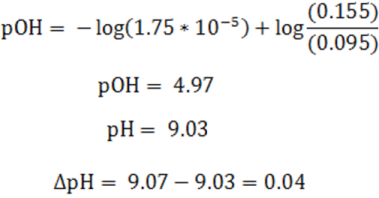
Como se puede observar la variación de pH es muy pequeño en este caso, resistiendo la adición del ácido fuerte.
Con la información presentada anteriormente podemos resaltar la importancia de reconocer las soluciones amortiguadoras o buffer, para así determinar su pH y analizar cómo pueden verse afectadas cuando suceden alteraciones al adicionar ácidos o bases, y determinar así cuales son los componentes adecuados y sus respectivas composiciones para que tengan la máxima capacidad amortiguadora en un determinado caso.
¡Espero la información les sea muy útil. Hasta una próxima oportunidad, gracias por leer!
Referencias
- Skoog, W. (2000). Química Analítica. Mc Graw Hill
- Whitten K. y Gailey, K. (1985). Química General. México: Nueva Editoral Interamericana