Síntesis de CuInSe2: Método Solvotérmico
Giovanni Marín
Mientras ponemos en funcionamiento el equipo de deposición de películas delgadas, vimos la oportunidad de seleccionar a un grupo de estudiantes para que realizaran su trabajo especial de grado, conocido como Tesis, tomando como tema cada uno de los procesos de preparación de los materiales semiconductores. En esta ocasión les presento algunos resultados de la síntesis del semiconductor CuInSe2 obtenido mediante el Método Solvotérmico.
Entre los semiconductores ternarios de Cobre (Cu), el que ha sido ampliamente estudiado y del cual se consiguen cerca de 117.000 resultados en Google Search es el CuInSe2, debido al valor de su brecha de energía que se encuentra en el rango óptimo para la conversión de energía solar a energía eléctrica, pero lo más importante es que este material presenta el mayor coeficiente de absorción óptica respecto al Silicio, Germanio, los compuestos binarios y ternarios que se utilizan en aplicaciones fotovoltaicas. En mi experiencia como investigador científico puedo afirmar que a pesar de contar con amplios puntos a favor, el CuInSe2 es un semiconductor difícil de obtener en forma de grandes monocristales, ya que suelen aparecer microgrietas y diversas direcciones de crecimiento en todo el lingote.

Fuente de Imagen: @iamphysical
Hace ya unos 7 meses que publiqué el artículo Ciencia y Tecnología: Estudio de los semiconductores ternarios , donde les comentaba la importancia de estudiar este tipo de materiales, y había dejado a un lado al CuInSe2 porque deseaba incursionar en el ESTUDIO DE NUEVOS MATERIALES, ya que ese era el nombre de la mención del postgrado que realicé en la Universidad de Los Andes, Mérida. Posteriormente retomé el estudio de este semiconductor, pero con la visión puesta en la formación de cristales a escala nano y micro, usando las técnicas de deposición mencionadas en mis últimas publicaciones y la síntesis por métodos físicos y químicos como baño químico, SILAR y solvotérmico, entre otros procesos de preparación de cristales semiconductores.

Introducción.
A partir de la revisión bibliográfica y formulación de las estrategias de investigación, nos propusimos a realizar la síntesis del CIS mediante el proceso solvotérmico con el objetivo de establecer los parámetros ideales para la aplicación de esta técnica de síntesis de materiales.
¿Por qué seleccionamos CuInSe2?
A pesar que es el más estudiado resultó ser el mejor candidato para poner a punto este método de síntesis, ya que sería más sencillo comparar nuestros resultados con lo reportado. Teníamos la base de datos cristalográficos en el equipo de Difracción de Rayos X y la calibración del Microscopio Electrónico de Barrido había sido un éxito para trabajar con una muestra patrón de CIS. Por si fuera poco, varios grupos de investigación del continente asiático estaban trabajando en esta misma línea de investigación y podíamos completar los resultados que ellos habían ignorado, esto se traduce en realizar experimentos tomando en cuenta la temperatura y tiempo de reacción que ellos no habían contemplado en sus experiencias. Entonces puedo resumir que la selección del CIS se debe a los siguientes factores:
- El CuInSe2 pertenecen a la familia de semiconductores I-III-VI2.
- Posee una banda prohibida directa de 1,02 eV y un coeficiente de absorción de 104 cm-1 [R1] .
- Este material semiconductor es favorable para distintas aplicaciones fotovoltaicas.
- Puede ser obtenido con conductividad eléctrica tipo p o tipo n con relativa facilidad.
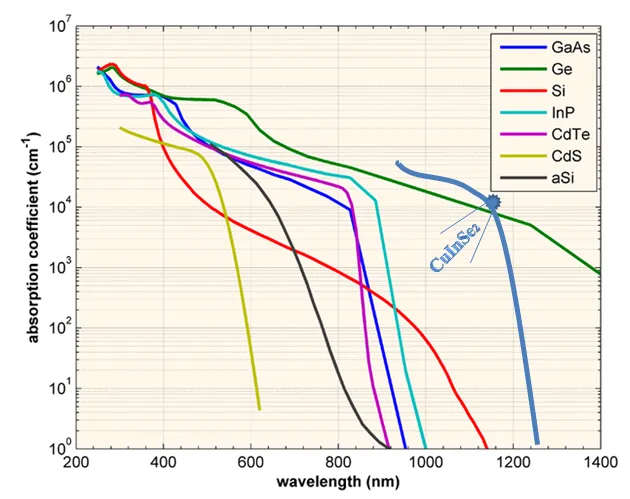
Absorción óptica de semiconductores. Adaptación de Christiana Honsberg, Stuart Bowden
En el rango óptimo de máxima irradiancia solar, el semiconductor CuInSe2 es el que tiene el más alto coeficiente de absorción óptica que hace posible obtener una mayor eficiencia en prototipos de celdas solares basadas en este material.

Método Solvotérmico y detalles técnicos.
Los métodos de síntesis y crecimiento para la obtención de este material requieren de alta temperatura (1150°C) y tiempos prolongados para la reacción (desde 1 hasta 8 semanas), generando altos costos de producción. En este trabajo realizamos la síntesis de micropartículas de CIS mediante el "Método Solvotérmico" que no requiere alta temperatura y se realiza de forma rápida en 2 días, creo que son motivos suficientes para tratar de obtener nanocristales de CIS de manera inmediata.
¿De qué se trata el Método Solvotérmico?
Es una metodología donde prevalece la Química, debido a que las reacciones de síntesis se llevan a cabo en solución líquida donde se mezclan sustancias químicas de alta pureza.
- Como el líquido es etilendiamina anhidra entonces se llama solvotérmico, en cambio si el medio líquido hubiese sido agua sería una síntesis hidrotérmica!.
- Todo el conjunto se coloca dentro de un autoclave o "Bomba Parr" sometida a una presión interna conocida como autógena y varía entre 750 Torr hasta 75000 Torr, dependiendo de la naturaleza de las sustancias que se colocan dentro del contenedor.
- La temperatura es controlada por encima de la temperatura ambiente pero menor a los 300 °C para proteger el depósito hecho de teflón.
- El tiempo para que se establezca la reacción y su estabilización es relativamente corto entre 1 y 4 días.
- No requiere de precursores organometálicos o tóxicos para producir CuInSe2 en polvo.
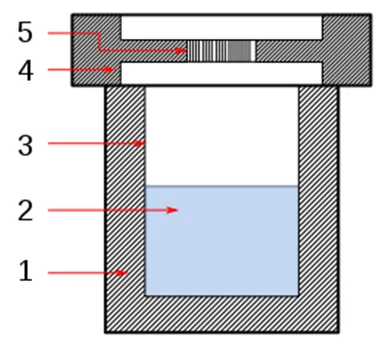
Partes de la Bomba Parr: 1) Capa de acero inoxidable, 2) Solvente, 3) Taza de teflón (100 mL), 4) Tapa de acero inoxidable y 5) Disco de ruptura. Dominio Público
Para que se forme el semiconductor es necesario que se establezcan condiciones ideales de temperatura, presión y tiempo para que la solución reaccione con la sustancia precursora y ocurra la síntesis de CIS. Esas serán nuestras variables a controlar, pero requiere de otros TIPs para ir poniendo a punto nuestros primeros ensayos de síntesis, recuerden que hasta este tipo de autoclave es nuevo para mi y nuestros tesistas!.

Detalles Experimentales.
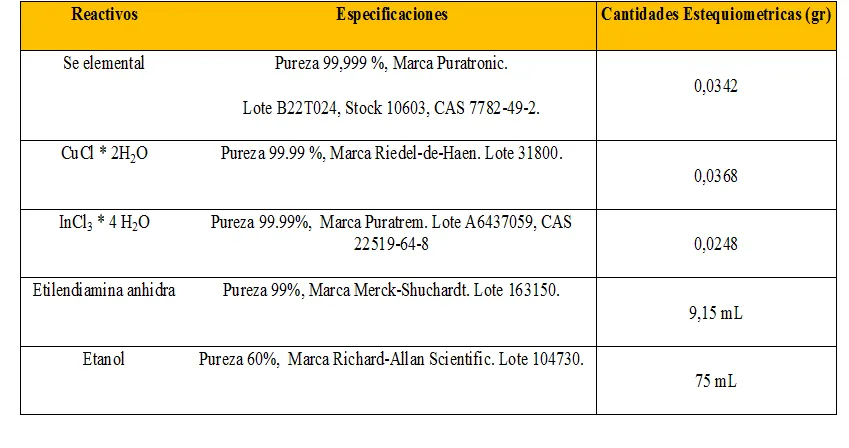
Ya habíamos establecido la estrategia de trabajo basada en la lectura de varios artículos científicos relacionados con la síntesis de CIS mediante el proceso solvotérmico [R2, R3 y [R4], así que nuestro tesista realizó 2 ensayos iniciales para verificar que disponíamos de todos los reactivos y equipos necesarios para implementar este método en nuestro segundo hogar llamado "Laboratorio".
Se procedió a realizar la primera síntesis controlando las variables mencionadas anteriormente.
- Usamos Indio y Selenio elemental, los cuales fueron cortados y triturados lo más pequeño posible. .
- La temperatura dentro del horno de calentamiento fue de 180 ºC.
- El tiempo de reacción fue de 16 horas.
- La fuente del Cobre fue a partir del CuCl dihidratado.
- Usamos etilendiamina anhidra como precursora de la reacción.
- Para el lavado del material resultante en la centrifugadora usamos etanol, conocido como alcohol etílico.
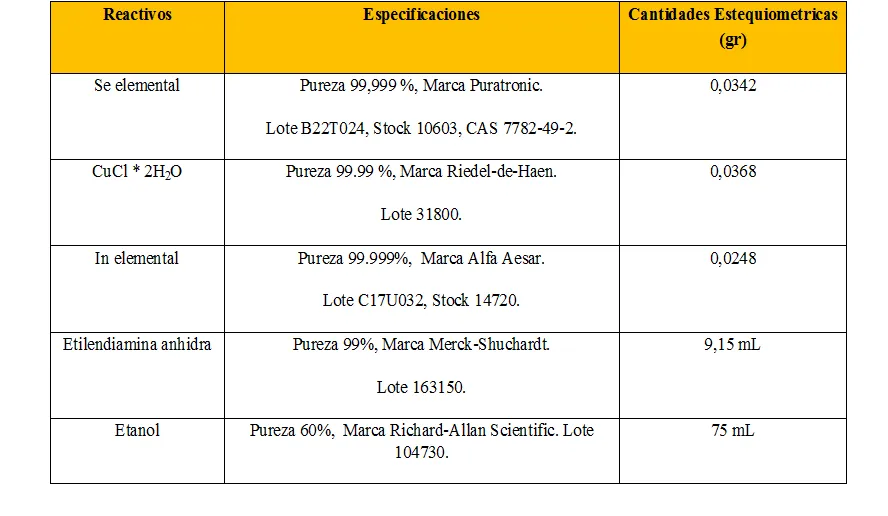

Fuente de Tabla e Imagen: @iamphysical.
Como se observa, obtuvimos un polvillo oscuro y se procedió a realizar la caracterización básica de composición química y análisis estructural, con los resultados que se muestran a continuación.
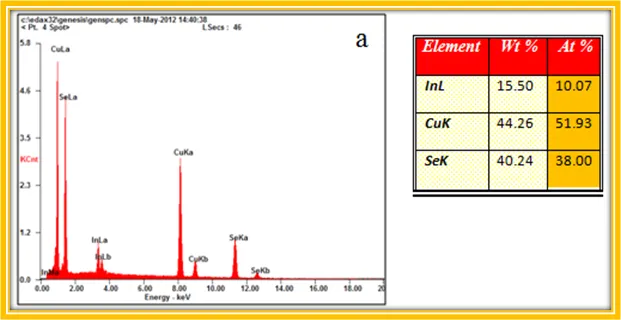
Fuente de Imagen: @iamphysical.
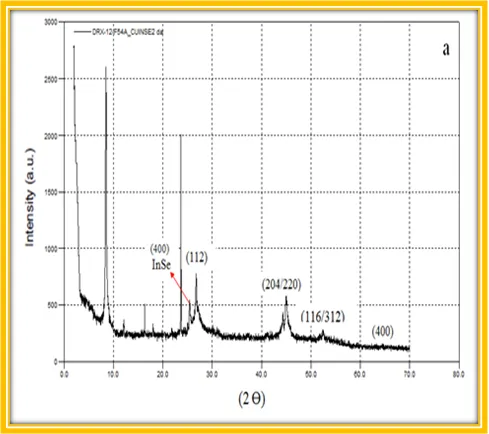
Difracción de Rayos X Los patrones de difracción del sólido obtenido fue analizado en un difractómetro de Rayos X, marca Brucker, modelo D8 Focus, con radiación Cu-Kα (longitud de onda λ= 1,54056 Å ), con tiempo de adquisición de 1s/ paso, en el intervalo 2θ desde 2 a 70 grados.
Microscopia Electrónica de Barrido Las imágenes para el análisis morfológico y de composición fueron obtenidas por un Microscopio Electrónico de Barrido marca FEI, modelo Quanta 200F, equipado con un sistema de microanálisis marca Edax, modelo Apolo 10.
No queda de otra, tengo que admitirlo, estos resultados son un desastre. Aparece una fase secundaria de InSe y Cu2Se, además la estequiometría es aun peor!.

Microfotografía de la muestra CuInSe2_1. Fuente de Imagen: @iamphysical.
A simple vista se observaron algunas piezas de tamaño mayor a nano y micromilímetros, suponemos que se trata de trozos de Indio metálico que no llegaron a reaccionar, por lo que decidimos realizar un segundo ensayo usando una sal de Indio para facilitar la reacción solvotérmica.
Experimento 2: CuInSe2_2.
Nuevamente seguimos el procedimiento detallado en la sección anterior y el parámetro que controlamos fue el uso del cloruro de indio (InCl3.4H2O). Esta sal será la fuente de los átomos de Indio requeridos para la formación del CIS. Vamos a ver que sucedió en este segundo ensayo.

Fuente de Tabla e Imagen: @iamphysical.
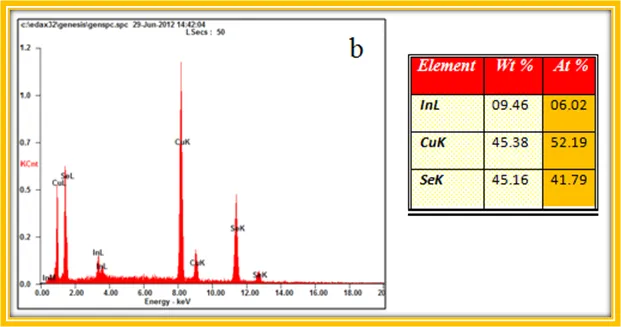
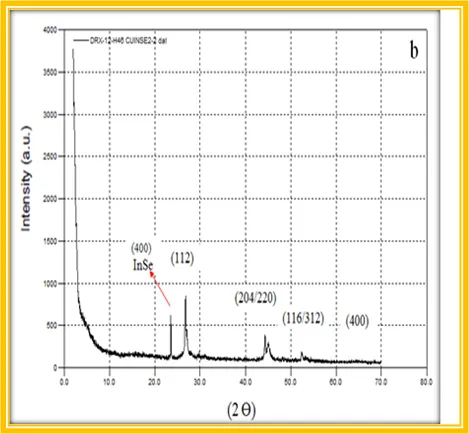
Se tuve especial cuidado en la etapa de centrifugación y lavado con alcohol etílico para evitar alguna influencia sobra la composición química. Los nanocristales obtenidos fueron caracterizados para hacer la comparación con los valores reportados.
Fuente de Imagen: @iamphysical.
La composición química resultó ser la siguiente: Cu:0,2 In:2,1 Se:1,7 , que evidentemente se aleja de la estequiometría ideal 1:1:2. También aparece la fase secundaria de InSe en el patrón de difracción de Rayos X, lo cual no es buena señal para establecer este procedimiento para la síntesis de nanocristales de CuInSe2.

Microfotografía de la muestra CuInSe2_2. Fuente de Imagen: @iamphysical.
Ya con los resultados anteriores es evidente que las microfotografías no aportan un análisis de importancia, ya que estamos trabajando con "cualquier cosa" menos con un semiconductor libre de defectos físicos y químicos.

Tiempo de reflexionar. . . . . . .
Esta sección es nueva para mi, pero la he querido insertar para seguir incentivando a los nuevos investigadores a no dejarse vencer por las adversidades que se puedan presentar en el transcurso de un trabajo de investigación, ya sea un proyecto, una tesis o una simple práctica de laboratorio. Es momento de detenerse, analizar los resultados y estudiar la metodología aplicada, por eso les recomiendo instalarse con su equipo de trabajo y discutan sobre la etapa que recién culminaron sin importar si son resultados buenos o malos.
Hasta ahora, espero haber aportado mi granito de arena en el amplio conocimiento de nuestra comunidad científica de habla hispana #stem-espanol con la serie de publicaciones sobre las técnicas de síntesis y caracterización de los materiales semiconductores, siempre habrá un lugar donde sean útiles en la forma de dispositivos optoelectrónicos. Pienso concluir este artículo hasta aquí para no hacerlo tan extenso, ya en la siguiente publicación veremos si existe una vía adecuada para la aplicación de este método y la obtención de nanocristales de semiconductores.

Bibliografía y lecturas recomendadas:
[R1] J. Phys. Chem. Solids 69 (2008) 637–640[R2] Thin Solid Films 517 (2009) 4174–4178
[R3] Rev. Latin Am. Metal. Mater. 2009; (3): 941-946
[R4] Chih-Hui Chang y col. Thin Solid Films 517 (2009) 4174–4178
[R5] Wei-Lun Lu. J. Phys. Chem. Solids 69 (2008) 637–640
○ Metodologías para la síntesis de nanopartículas.
○ Síntesis solvotermal.
○ Síntesis de Cordieritas.
○ Síntesis Solvotérmica.
○ Efecto del solvente de lavado sobre la síntesis.
En nuestra comunidad se promocionan y valoran las publicaciones de alto impacto relacionados con Ciencia, Tecnología, Ingeniería y Matemáticas, dale clic a la etiqueta #steemstem, para que te enteres de nuestro trabajo de calidad científica!.

